Imidazols
Imidazols (1,3-diazols, glioksalīns, C3H4N2) pieder pie azolu grupas heterocikliskajiem "aromātiskajiem" savienojumiem. Tā pieclocekļu cikls satur divus slāpekļa atomus, starp kuriem ir viens oglekļa atoms (struktūra līdzīga oksazola un tiazola gredzeniem, tikai skābekļa vai sēra atomu vietā satur iminogrupu −NH−). Šis cikls ir daudzu dabisku un sintētiski iegūtu savienojumu sastāvā. Imidazols ir bezkrāsaina vai iedzeltena cieta viela (prizmveida kristāli no benzola). Viegli šķīst ūdenī. Imidazolam ir neparasti augsta viršanas temperatūra - tas izskaidrojams ar tā molekulu mijiedarbību ar iminogrupu starpniecību.
| Imidazols | |
|---|---|
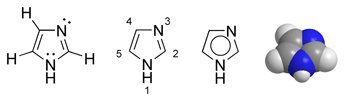 Imidazola dažādu veidu struktūrformulas un molekulas modelis | |
| Ķīmiskā formula | C3H4N2 |
| Molmasa | 68,08 g/mol |
| Blīvums | 1230 kg/m3 |
| Kušanas temperatūra | 89-91 °C |
| Viršanas temperatūra | 256 °C |
Atrašanās dabā
labot šo sadaļuSvarīgākā dabasviela, kas satur imidazola struktūru, ir aminoskābe histidīns. Skābju vai baktēriju iedarbībā šī aminoskābe dekarboksilējas līdz β-imidazoliletilamīnam jeb histamīnam, kas ir svarīga bioloģiski aktīva viela - daudzu dzīvībai svarīgu organisma funkciju regulators. Imidazola gredzens ir daudzu alkaloīdu, piemēram, pilokarpīna pamatā. Tas ir arī purīnvielu struktūrelements.
Iegūšana
labot šo sadaļuImidazola tipa savienojumu vispārīga sintēzes metode pamatojas uz 1,2-dikarbonilsavienojumu kondensāciju ar amonjaku un aldehīdiem (aizstājot daļu amonjaka ar amīniem, var iegūt N-aizvietotos imidazolus). Kondensējot glioksālu ar amonjaku un formaldehīdu, veidojas pats imidazols, tādēļ imidazolu dažkārt sauc par glioksalīnu.
Īpašības
labot šo sadaļuImidazoli būtiski atšķiras no piroliem ar lielāku bāziskumu (tie ir labi nukleofilie reaģenti). Ar neorganiskām skābēm tie veido sāļus, kuri nehidrolizējas. No otras puses, imidazols un tā N-neaizvietotie atvasinājumi var aizvietot ūdeņraža atomu pie slāpekļa ar metāla atomu (piemēram, pazīstams kālija un imidazola savienojums, kurā ūdeņraža atoms iminogrupā aizvietots ar kāliju - imidazolkālijs).
Imidazols un imidazolkālijs reaģē ar halogēnalkāniem, veidojot N-alkilimidazolus; karsējot tie pārgrupējas par 2-alkilimidazoliem. N-alkilimidazoli spēj arī alkilēties tālāk, veidojot imidazolija sāļus.
Imidazols ir noturīgs pret reducētāju iedarbību. Arī spēcīgi oksidētāji, piemēram, hromskābe, uz to neiedarbojas (taču kālija permanganāts pilnībā sagrauj imidazola gredzenu). Iedarbojoties ar ozonu, notiek starp diviem oglekļa atomiem esošās divkāršās saites saraušana.
Izmantošana
labot šo sadaļuImidazolu lieto kā dažu metālu (piemēram, vara) korozijas inhibitoru. Imidazola gredzens ir daudzu medikamentu molekulu sastāvdaļa.
| Hetero- atomi |
Trīslocekļu cikli | Četrlocekļu cikli | Pieclocekļu cikli | Sešlocekļu cikli | Septiņlocekļu cikli | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie | |
| O | Oksirāns | Oksirēns | Oksetāns | Oksets | Tetrahidrofurāns | Furāns | Tetrahidropirāns | Pirāns | Oksepāns | Oksepīns |
| S | Tiirāns | Tiirēns | Tietāns | Tiets | Tetrahidrotiofēns | Tiofēns | Tiāns | Tiīns | Tiepāns | Tiepīns |
| N | Aziridīns | Azirīns | Azetidīns | Azets | Pirolidīns | Pirols Pirolīns Indols*** Karbazols**** |
Piperidīns Hinuklidīns* |
Piridīns Hinolīns*** Izohinolīns*** Akridīns**** |
Azepāns | Azepīns |
| 2O | Dioksetāns | Dioksolāns | Dioksāns | |||||||
| 2N | Diazets | Pirazolidīns Imidazolidīns |
Pirazols Imidazols Pirazolīns Imidazolīns |
Piperazīns | Pirazīns Pirimidīns Piridazīns |
Diazepāns | Diazepīns | |||
| 3N | Triazols Benztriazols*** |
Triazīns | ||||||||
| 4N | Tetrazols | Tetrazīns | ||||||||
| 5N | Pentazols** | |||||||||
| S + N | Tiazolidīns | Tiazols Izotiazols |
Tiomorfolīns | Tiazīns | ||||||
| O + N | Oksaziridīns | Izoksazols Oksazols |
Morfolīns | Oksazīns | ||||||
| O + 2N | Furazāns | Oksadiazīns | ||||||||
- *divi sajūgti sešlocekļu cikli **cikls sastāv tikai no slāpekļa atomiem ***satur kondensētu benzola gredzenu ****satur 2 kondensētus benzola gredzenus