Stehiometrija
Stehiometrija (no sengrieķu στοιχεῖον — 'elements' un μετρέω — 'mērīt') ir noteikumu sistēma ķīmijā, pēc kuras tiek noteikts vielu sastāvs un vielu daudzums ķīmiskajās reakcijās.
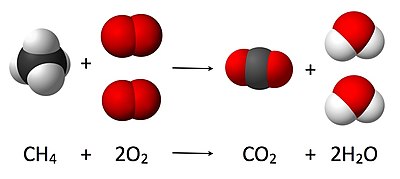
Stehiometriskās attiecības
labot šo sadaļuStarp mikropasaules elementārobjektiem (atomiem, joniem, molekulām) var pastāvēt noteiktas skaitliskās attiecības, ko sauc par stehiometriskām attiecībām. Šīs stehiometriskās attiecības makropasaulē izpaužas kā attiecības starp vielas sastāvdaļu daudzumiem vai ķīmiskas reakcijas izejvielu un produktu daudzumiem. Ja elementārobjekti, piemēram, atomi, veido sarežģītākus elementārobjektus, piemēram, molekulas vai formulvienības, tad starp tiem pastāv stehiometriskas attiecības. Tā nātrija tiosulfātā (Na2S2O3) sēra un nātrija daudzumi molos ir attiecībā 1:1, bet nātrija un skābekļa — attiecībā 2:3. Katrā saharozes (C12H22O11) molekulā vienmēr ir 12 oglekļa atomi (saharozes daudzums attiecas pret tajā ietilpstošā oglekļa daudzumu kā 1:12), bet, piemēram, skābekļa un ūdeņraža attiecība saharozē ir 1:2, tāpat kā ūdens molekulā (tādēļ saharozi un citus cukurus dēvē par ogļhidrātiem, jo tie it kā sastāv no oglekļa un ūdens).
Analītiskajā ķīmijā stehiometriskās attiecības plaši izmanto, lai veiktu dažādus aprēķinus.[1]
Ne visiem ķīmiskajiem savienojumiem ir stingri noteikts (stehiometrisks) sastāvs. Daudzām kristāliskām vielām sastāvs var būt mainīgs, jo ne visi kristālrežģa mezgli vienmēr tiek aizņemti, bez tam starpmezglu telpā var izvietoties lielāks vai mazāks daudzums pārākumā esošu atomu vai jonu. Piemēram, titāna(II) oksīdam, kura formulu parasti raksta kā TiO, reālais sastāvs var būt no Ti0,7O līdz TiO1,3. Tādus savienojumus sauc par nestehiometriskiem savienojumiem jeb bertolīdiem atšķirībā no stehiometriskajiem savienojumiem jeb daltonīdiem. Patiesībā visi cietie savienojumi, izņemot vielas ar molekulu režģi (cukurs, sasalis ūdens, CO2, amonjaks), ir ar mainīgu sastāvu, tikai novirzes no stehiometrijas mēdz būt tik niecīgas, ka ir grūti konstatējamas ar parastām analīzes metodēm.[2]
Stehiometriskie aprēķini
labot šo sadaļuJa ķīmiskajā reakcijā izejviela pilnīgi izreaģē, tad tās daudzums un iegūtā produkta daudzums savstarpēji attiecas tāpat kā koeficienti reakcijas vienādojumā, tādējādi, izmantojot stehiometrisko vienādojumu, ja zināms vismaz vienas vielas daudzums, var aprēķināt pārējo vielu teorētiskos daudzumus.
Teorētiskais iznākums ir ķīmiskās reakcijas produkta masa vai tilpums, kuru iegūst, veicot aprēķinus pēc reakcijas stehiometriskā vienādojuma. Praktiskais iznākums ir ķīmiskās reakcijas produkta masa vai tilpums, kuru iegūst īstenībā. Attiecība starp praktisko iznākumu (masu vai tilpumu) un teorētisko iznākumu (masu vai tilpumu) ir relatīvais reakcijas iznākums . Ja teorētiskais iznākums ir vienāds ar praktisko iznākumu, to sauc par kvantitatīvo iznākumu. Limitējošais reaģents ir izejviela, kuras daudzums atbilstoši stehiometriskajam vienādojumam ir vismazākais, teorētisko iznākumu aprēķina pēc šī reaģenta.[3]
Stehiometrija un ķīmiskā termodinamika
labot šo sadaļuĶīmiskajā termodinamikā tiek izmantoti termoķīmiskie vienādojumi — stehiometriskie vienādojumi, kuros norādīti ķīmisko reakciju siltumefekti (entalpijas izmaiņas) un visu vielu agregātstāvokļi (tie tiek norādīti, jo vienai un tai pašai vielai entalpija ir vislielākā gāzveida stāvoklī, mazāka šķidrā, bet vismazākā tā ir cietā stāvoklī). Arī šajos vienādojumos koeficienti veselos skaitļos rāda reaģējošo vielu un produktu daudzumu attiecību, taču tajos var būt arī daļskaitļu koeficienti.[3]
Atsauces
labot šo sadaļu- ↑ Edgars Jansons. Analītiskās ķīmijas teorētiskie pamati. Rīga : Zvaigzne, 1993, 6. lpp. ISBN 5-405-00602-5
- ↑ Nails Ahmetovs. Neorganiskā ķīmija. Rīga : Zvaigzne, 1978, 268. lpp.
- ↑ 3,0 3,1 Valdis Kokars. Vispārīgā ķīmija. Rīgas Tehniskā universitāte, 2009. 27.—29. lpp. ISBN 978-9984-32-700-6.
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |