Etiķskābe
Etiķskābe, pazīstama arī kā etānskābe, ir organisks savienojums, kurš piešķir etiķim tā skābo garšu un kodīgu smaržu. Tā ķīmiskā formula ir CH3COOH. Tīra, ar citām vielām nesajaukta etiķskābe ir bezkrāsains, caurspīdīgs, higroskopisks šķidrums ar asu etiķa smaku. Tīra etiķskābe sasalst jau pie 16 °C, tādēļ absolūto jeb 100% etiķskābi mēdz dēvēt par ledus etiķskābi. Etiķskābe ir kodīga viela, tās tvaiki var izraisīt acs iekaisumus, deguns var kļūt sauss un mazliet dedzināt, rīklē var rasties mokošas sāpes, plaušās var sākt trūkt gaisa un cilvēks var sākt smakt. Tomēr tā ir vāja skābe, jo normālos apstākļos skābes disociācijā eksistē līdzsvars starp ūdeni saturošiem šķīdumiem, pretēji stiprajām skābēm, kuras pilnībā disociējas.
| Etiķskābe | |
|---|---|
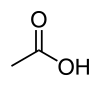  Etiķskābes struktūrformula un molekulas modelis | |
| Citi nosaukumi |
Etānskābe Metānkarbonskābe |
| Ķīmiskā formula | CH3COOH |
| Molmasa | 60,05 g/mol |
| Blīvums |
šķidrums 1049 kg/m3 cietviela 1266 kg/m3 |
| Kušanas temperatūra | 289,6 K (16,5 °C) |
| Viršanas temperatūra | 391,2 K (118,1 °C) |
Etiķskābe ir pazīstamākā karbonskābe un otra vienkāršākā karbonskābe uzreiz pēc skudrskābes. Tā ir svarīga rūpniecības ķimikālija un ķīmiskais reaģents. To izmanto polietilēntereftalāta ražošanā, no kā galvenokārt izgatavo dzirkstošo dzērienu pudeles, kā arī vēl citur.
Etiķskābi var iegūt, oksidējot acetaldehīdu un bioķīmiski no etilspirtu saturošiem šķīdumiem. Etiķskābes sāļus un esterus sauc par acetātiem (latīņu: acetum - etiķis).
Vēsture
labot šo sadaļuVīna etiķa veidā etiķskābe bija pazīstama jau senatnē. Pēc Plīnija nostāsta, Kleopatra lietojusi dzērienu no etiķī izšķīdinātām pērlēm. Taču koncentrētu etiķskābi iemācījās iegūt tikai pirms apmēram 250 gadiem.
Atrašanās dabā
labot šo sadaļuEtiķskābe ir ļoti izplatīta augu valstī. Dažreiz augi satur etiķskābi brīvā veidā, bet biežāk esteru veidā. Etiķskābe atrodama arī dažu dzīvnieku izdalījumos. Daudzi mikroorganismi, sēnītes un baktērijas spēj sašķelt organiskas vielas līdz etiķskābei. Tādēļ etiķskābe veidojas skābā pienā, sierā un it sevišķi spirtu saturošu šķidrumu etiķskābās rūgšanas procesā.
Iegūšana
labot šo sadaļu- Oksidējot acetaldehīdu katalizatora klātienē (par katalizatoriem lieto mangāna, kobalta vai hroma peroksīdus):
- CH3CHO + 0,5O2 → CH3COOH
Šī metode ir dārga, un mūsdienās to vairs plaši nelieto. Šādā veidā var iegūt ≈ 95% galaprodukta iznākumu. Galvenie blakusprodukti ir skudrskābe, etilacetāts un formaldehīds.
- Karbonilējot metanolu katalizatora klātienē (par katalizatoriem parasti lieto platīnmetālu karboniljodīdus):
- CH3OH + CO → CH3COOH
Pirms bija atklāti efektīvi katalizatori, šim procesam vajadzēja ļoti lielu spiedienu (≈ 200 MPa) un reakcijas maisījums bija korozīvs. Izejvielas (metanols un oglekļa monoksīds) ir lētas un plaši pieejamas, tāpēc šī mūsdienās ir galvenā etiķskābes ražošanas metode. Modificējot apstākļus, iespējams ražot arī acetanhidrīdu.
- Oksidējot ogļūdeņražus (pamatā butānu)(katalizatori ir līdzīgi, kā oksidējot acetaldehīdu):
- 2C4H10 + 5O2 → 4CH3COOH + 2H2O
Izejviela nav pārāk dārga, taču te veidojas daudz blakusproduktu (butanons, etilacetāts, skudrskābe, propionskābe), kuru atdalīšana palielina izmaksas. Šo procesu dažreiz modificē šo blakusproduktu ražošanai.
- Aerobi fermentējot etanolu:
- CH3CH2OH + O2 → CH3COOH + H2O
Process notiek baktēriju iedarbībā. Šādā veidā ražo gandrīz visu dabiskās izcelsmes etiķskābi.
- Anaerobi fermentējot ogļhidrātus:
- C6H12O6 → 3CH3COOH
Lai arī šeit potenciāli ir iespējams lielāks iznākums, te lietotās baktērijas ir mazāk noturīgas pret skābi un te var iegūt tikai atšķaidītāku skābi. Šī iemesla dēļ šo procesu plaši nelieto.
Īpašības
labot šo sadaļuEtiķskābes ūdens šķīdumiem blīvuma maksimums (1070 kg/m3) ir pie koncentrācijas 77%, kas atbilst monohidrātam. Tādēļ iespējams, ka 77% etiķskābe īstenībā ir etiķskābes ortoforma CH3C(OH)3.
Izmantošana
labot šo sadaļuEtiķskābi lieto par izejvielu vairāku polimēru ražošanai, ķīmiskajām sintēzēm, krāsvielu ražošanā un citur. Atšķaidītu etiķskābi sauc par etiķi un lieto par pārtikas piedevu ar apzīmējumu E260.
- Kristāliska ledus etiķskābe