Ciklopropāns
Ciklopropāns (C3H6) ir bezkrāsaina gāze ar petrolēterim līdzīgu smaku. Ūdenī nešķīst, viegli šķīst etanolā un ēterī. Ciklopropāns ir visvienkāršākais cikloalkāns.
| Ciklopropāns | |
|---|---|
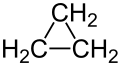  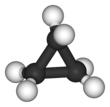  Ciklopropāna struktūrformulas un molekulas modeļi | |
| Citi nosaukumi | trimetilēns |
| CAS numurs | 75-19-4 |
| Ķīmiskā formula | C3H6 |
| Molmasa | 42,08 g/mol |
| Blīvums | 1,879 kg/m3 |
| Kušanas temperatūra | -127,42 °C |
| Viršanas temperatūra | -32,8 °C[1] |
| Šķīdība ūdenī | nešķīst |
Vēsture
labot šo sadaļuCiklopropānu ieguva austriešu ķīmiķis Augusts Freinds (August Freund) 1881. gadā, viņš arī pareizi izskaidroja jauniegūtās vielas molekulas struktūru savā pirmajā zinātniskajā rakstā. Ciklopropānam nebija praktiskas nozīmes līdz tā anestētisko īpašību atklāšanai 1929. gadā.[2] 1936. gadā ciklopropānu sāka ražot rūpnieciski.[3]
Molekulas uzbūve
labot šo sadaļuCiklopropāna molekulai ir regulāra trijstūra forma, tādēļ leņķi starp oglekļa atomiem ir 60°, savukārt leņķi HCH ir gandrīz 120°. Tādi leņķi stipri atšķiras no sp3 hibridizācijā esoša oglekļa atoma parastajiem tetraedriskajiem leņķiem (109°28') — tie ir stipri "saspriegti". Vācu ķīmiķis Ādolfs fon Beiers 1885. gadā ar šo saspriegšanu izskaidroja ciklopropāna lielo, piesātinātajiem ogļūdeņražiem neraksturīgo, reaģētspēju. To sauc par Beiera sprieguma teoriju.
Tā kā ciklopropāna molekula ir planāra, ūdeņraža atomu aizvietotāji ciklopropāna atvasinājumos var izvietoties vienā vai otrā molekulas plaknes pusē. Tādējādi 1,2-divaizvietotajiem ciklopropāniem raksturīga cis-trans izomērija, bet trans izomēriem savukārt iespējama optiskā aktivitāte. Piemēram, ir pazīstama cis-1,2-ciklopropāndikarbonskābe, kas viegli veido anhidrīdu un trans-1,2-ciklopropāndikarbonskābe, kura anhidrīdu neveido, jo abas karboksilgrupas ir tālu viena no otras. Racēmisko trans-1,2-ciklopropāndikarbonskābi iespējams sadalīt divos optiskajos izomēros.
Shematisks trans-1,2-dimetilciklopropāna optisko izomēru attēlojums
Iegūšana
labot šo sadaļuCiklopropānu iegūst no 1,3-dibrompropāna.[4] Ciklopropāns veidojas iekšmolekulārā Virca reakcijā, 1,3-dibrompropānam reaģējot ar nātriju vai cinka putekļiem. Šos Virca reakcijas paveidus sauc attiecīgi par Freinda reakciju un Gustavsona reakciju. Ir pazīstami vairāki specifiski ciklopropāna atvasinājumu iegūšanas veidi, ko sauc par ciklopropanācijas reakcijām.
Atrašanās dabā
labot šo sadaļuDažas dabasvielas ir ciklopropāna atvasinājumi, piemēram, piretroīdi (atrodami Pyréthrum ģints augos).
Ķīmiskās īpašības
labot šo sadaļuCiklopropāns viegli stājas pievienošanas reakcijās, šajā ziņā tas līdzīgs alkēniem. Pievienojot ūdeņradi, rodas propāns, pievienojot halogēnus vai halogēnūdeņražus — propāna halogēnatvasinājumi. Pievienošanās reakcijās notiek cikla atvēršanās (uzslēgšanās).
Sašķidrināts ciklopropāns var eksplodēt pats no sevis! Sevišķi bīstams ciklopropāns ir skābekļa klātienē! |
Par spīti ciklopropāna lielajai reaģētspējai, auksts kālija permanganāta šķīdums uz šo ciklu neiedarbojas, tādējādi permanganāta reakcija ar dubultsaitēm paliek specifiska arī ciklopropāna atvasinājumu klātienē.
Laižot ciklopropānu cauri nokaitētai caurulītei, tas pārvēršas par propilēnu. Katalizatoru (dzelzs skaidiņu vai platīna) klātienē šī reakcija notiek pat 50 °C temperatūrā.
Izkliedētā dienas gaismā hlors nevis atver ciklopropāna gredzenu, bet aizvieto tajā ūdeņradi, veidojoties monohlorciklopropānam. Tas ir gaistošs šķidrums ar patīkamu smaržu.[5]
Izmantošana
labot šo sadaļuIzmanto organiskajā sintēzē, kā arī medicīnā kā anestezējošu līdzekli. Ciklopropāns cilvēkam ir samērā nekaitīgs, ātri iedarbojas un ātri izdalās no organisma. Tomēr ciklopropānu mūsdienās narkozei izmanto reti tā lielās sprādzienbīstamības dēļ.
Atsauces
labot šo sadaļu- ↑ Справочник химика. Том II. Основные свойства неорганических и органических соединеный. Л.,"Химия", 1971, 1107. lpp. (krieviski)
- ↑ G. H. W. Lucas and V. E. Henderson (1 August 1929). "A New Anæsthetic: Cyclopropane". Can Med Assoc J. 21 (2): 173–5. PMC 1710967. PMID 20317448.
- ↑ H. B. Hass, E. T. McBee, and G. E. Hinds (1936). "Synthesis of Cyclopropane". Industrial & Engineering Chemistry 28 (10): 1178–81. doi:10.1021/ie50322a013.
- ↑ O. Neilands. Organiskā ķīmija. R:, Zvaigzne, 1977, 137. lpp.
- ↑ П. Каррер. Курс органической химии. Ленинград: Государственное научно-техническое издательство химической литературы, 1960, 780. lpp. (krieviski)
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ciklopropāns |