Aldehīdi
Aldehīdi ir skābekli saturoši organiski savienojumi, kurus var iegūt, dehidrogenējot pirmējos spirtus. No tā arī cēlies aldehīdu nosaukums (latīņu: al(cohol) dehyd(rogenatum) — dehidrogenēts spirts). Aldehīdi var izomerizēties par enoliem, taču aldehīda forma ir daudz stabilāka. Aldehīdi var oksidēties, veidojot karbonskābes.
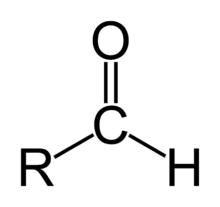
Aldehīdus kopā ar ketoniem pieskaita pie karbonilsavienojumiem. Aldehīda grupa sastāv no karbonilgrupas, kam viens no aizvietotājiem ir ūdeņradis. Savienojumos, kas satur aizvietotājus ar lielāku prioritāti, aldehīda grupu nosauc kā formil-, piem 4-formilbenzoskābe (OHC-C6H4-COOH). Aldehīdi ir ķīmiski aktīvāki par ketoniem, un tos dažreiz lieto par reducētājiem.
Visiem aldehīdiem piemīt raksturīgs aromāts. Zemākajiem aldehīdiem ir asa, nepatīkama smaka, bet aizvietotāja oglekļa atomu ķēdei pagarinoties, aldehīdu smarža kļūst līdzīga augļu un ziedu smaržai. Šādas funkcionālās grupas kā aldehīdgrupu, kas padara vielu aromātisku, sauc par osmoforām grupām. Vairāki aldehīdi piešķir raksturīgo smaržu un garšu augļiem, garšvielām, un to smarža ir ļoti patīkama.
Aldehīdiem ir zema viršanas temperatūra. To var izskaidrot tādējādi, ka starp aldehīdu molekulām neveidojas ūdeņraža saite. Aldehīdu šķīdība, pieaugot to molekulmasai, ievērojami samazinās. Ūdenī praktiski šķīst tikai vienkāršākie aldehīdi.
Reakcijas
labot šo sadaļuNukleofilā pievienošanās
labot šo sadaļuViens no aldehīdu reakciju pamattipiem ir nukleofilā pievienošanās pie C=O dubultsaites. Šajā gadījumā reakcijas centrs aldehīda molekulā ir oglekļa atoms, kas tieši saistīts ar skābekļa atomu.
Hidratācija
labot šo sadaļuAldehīdi var veidot hidrātus, pievienojot ūdeni, taču parasti brīvā veidā šādi savienojumi ir ļoti nestabili, kā visi savienojumi, kam ir geminālās (abas pie viena oglekļa atoma) hidroksilgrupas. Tomēr vienkāršākie aldehīdi un aldehīdi, kuriem aldehīdgrupas tuvumā ir aizvietotāji ar pietiekoši stipru negatīvo indukcijas efektu hidratējas diezgan viegli.[1] Formaldehīds ūdens šķīdumā par 99,96% pāriet hidrāta formā, acetaldehīdam hidrātā pārvēršas apmēram puse molekulu, bet terc-butilaldehīds hidratējas apmēram par 19%. Tas izskaidrojams ar aizvietotāju atšķirīgām elektrondonorām īpašībām — vienam vienīgajam ūdeņraža atomam formaldehīdā nav tik stipra pozitīvā indukcijas efekta kā terc-butilgrupai, tātad pozitīvais daļlādiņš uz karbonilgrupas paliek nekompensēts, kas palielina šīs grupas oglekļa atoma elektrofilitāti un skābekļa atoma nukleofilitāti (resp., tā kļūst aktīvāka). Savukārt hlorāla jeb trihloracetaldehīda gadījumā aizvietotājs tik stipri "atvelk" karbonilgrupas elektronus, ka hidratācija ir izteikti patvaļīga, un hidrātu (hlorālhidrātu) iespējams izolēt pat cietā veidā.
Pusacetālu un acetālu veidošanās
labot šo sadaļuJa aldehīdu hidrātu hidroksilgrupām ūdeņraža atomus aizvieto ar organiskiem radikāļiem, šādi savienojumi arī ir stabili un tos dēvē par acetāliem:
- R−CH(O−R')2 .
Tie veidojas aldehīdu reakcijās ar spirtiem, kuri šeit acīmredzami darbojas kā ūdens analogi, kuros viena H vietā ir ogļūdeņraža atlikums. Viena aizvietotā atoma gadījumā savienojumu dēvē par pusacetālu.
Ciānhidrīnu veidošanās
labot šo sadaļuPazīstams nukleofils aģents ir cianogrupa, un reakcijā ar to no aldehīdiem veidojas ciānhidrīni. Šīs reakcijas mehānisms ir ļoti vienkāršs un labi der par sākuma piemēru visai reakciju klasei.
N nukleofilu pievienošanās
labot šo sadaļuParasti tā ir amīnu pievienošana.
- Pirmējo amīnu pievienošanās procesā veidojas imīni jeb azometīni. Gadījumā, ja pievienojas hidroksilamīns, rodas oksīmi, bet hidrazīns dod hidrazonus. Tad shēmā attēlotais R3 atbilst attiecīgi -OH vai -NH2 grupai.
- Otrējiem amīniem reakcijas gaitā nav iespējama otrā ūdeņraža atoma atšķelšana pie slāpekļa atoma, jo tāda ūdeņraža vienkārši nav (pirmais H atoms pāriet pie skābekļa atoma; ne obligāti tas ir tas pats H atoms, kas atdalās no slāpekļa un pievienojas pie skābekļa, jo parasti pastāv mijiedarbība ar šķīdinātāja molekulām). Tāpēc vai nu tiek atšķelts α-H atoms un veidojas enamīns, vai nu pievienojas vēl viena amīna molekula, rodoties diamīnam. Šis pēdējais variants ir īpaši raksturīgs gadījumā, ja aldehīdā neeksistē α ūdeņraža atoms, kā tas ir formaldehīdam un aromātiskajiem aldehīdiem, ja formilgrupa ir tieši saistīta ar aromātisko sistēmu.
Savienojumu piemēri
labot šo sadaļuPazīstamākais aldehīds ir formaldehīds. Pie aldehīdiem var pieskaitīt arī glicerīna termiskās sadalīšanās produktu - akroleīnu.
Atsauces
labot šo sadaļu- ↑ V. Kokara lekcijas RTU.