Slāpekļskābe
Slāpekļskābe (HNO3) ir korozīvs šķidrums, kas sasalstot pārvēršas par caurspīdīgu kristālisku masu. Slāpekļskābes ūdens šķīdums ir stipra neorganiskā skābe. Tīra slāpekļskābe ir bezkrāsaina, bet ar laiku tā sāk sadalīties un tajā uzkrājas slāpekļa oksīdi, kas nokrāso šķidrumu dzeltenīgu. Slāpekļskābes sāļus sauc par nitrātiem.
| Slāpekļskābe | |
|---|---|
 Slāpekļskābes struktūrformula ar starpatomu attālumiem un leņķiem 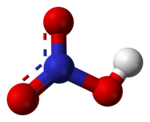 Slāpekļskābes molekulas modelis (ar raustītām līnijām attēlotas delokalizētās saites) | |
| Citi nosaukumi | ūdeņraža trioksonitrāts(V) |
| CAS numurs | 7697-37-2 |
| Ķīmiskā formula | HNO3 |
| Molmasa | 63,0 g/mol |
| Blīvums | 1580 kg/m3 |
| Kušanas temperatūra | 231 K (-42 °C) |
| Viršanas temperatūra | 356 K (83 °C) |
| Šķīdība ūdenī | jaucas jebkurās attiecībās |
Atrašanās dabā labot šo sadaļu
Slāpekļskābe ir nozīmīga skābā lietus sastāvdaļa.
Iegūšana labot šo sadaļu
Slāpekļskābi iegūst, šķīdinot ūdenī slāpekļa dioksīdu NO2 skābekļa klātienē. Tā ir salikta reakcija, kurā vispirms veidojas slāpekļa(V) oksīds, kurš pēc tam reaģē ar ūdeni.
- 4NO2 + O2 → 2N2O5
- N2O5 + H2O → 2HNO3
Slāpekļskābi var iegūt arī, sērskābei reaģējot ar slāpekļskābes sāļiem.
- 2MeNO3 + H2SO4 → Me2SO4 + 2HNO3
Piemēram dots reakcijas vienādojums ar kālija nitrātu:
- H2SO4 + 2KNO3 → K2SO4 + 2HNO3.
Šādā veidā var iegūt samērā koncentrētu skābi, taču tā ir gāzveida fāzē un to ir nepieciešams kondensēt. 19. gadsimtā, kad vēl nebija atklāta metode slāpekļskābes ieguvei no slāpekļa oksīda (kuru iegūst, oksidējot amonjaku), tā bija vienīgā slāpekļskābes ieguves metode.
Īpašības labot šo sadaļu
Slāpekļskābe pieder pie ļoti spēcīgiem oksidētājiem, kas spēj oksidēt gandrīz visus metālus un nemetālus, kā arī noārdīt augu un dzīvnieku audus.
Koncentrēta slāpekļskābe ir bīstama kodīga viela! Pat nelielos daudzumos tā atstāj uz ādas dzeltenus plankumus. |
Slāpekļskābes maisījumu ar sālsskābi attiecībā 1:3 sauc par karaļūdeni. Karaļūdens spēj šķīdināt pat tādus neaktīvus metālus kā zelts un platīns.
Apgaismojot vai sildot slāpekļskābe sadalās:
- 4HNO3 → 4NO2 +O2 + 2H2O
Izmantošana labot šo sadaļu
Slāpekļskābi lieto daudzu sprāgstvielu ieguvei, kā arī minerālmēslu, organisko krāsvielu un plastmasu ražošanā. Daži nitrāti ir nozīmīgi kā minerālmēslojums.
Ārējās saites labot šo sadaļu
- Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Slāpekļskābe.
- Encyclopædia Britannica raksts (angliski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
- Encyclopædia Universalis raksts (franciski)