Orbitāle
- Šis raksts ir par atoma orbitāli. Par citām jēdziena orbitāle nozīmēm skatīt nozīmju atdalīšanas lapu.
Orbitāle jeb, precīzāk, atomārā orbitāle, vienkāršotā skaidrojumā ir tā telpas daļa ap atoma kodolu, kur elektrona atrašanās vieta ir visvarbūtīgākā.[1] Matemātiski orbitāle ir uzskatāma par elektrona viļņu funkciju, kuras jēga izriet no Šrēdingera viļņu vienādojuma. Elektroni neriņķo ap atoma kodolu pa tādām orbītām, kā planētas ap Sauli, kaut arī novecojušo Bora atoma uzbūves modeli joprojām mēdz izmantot mākslinieciskos zīmējumos. Elektroniem saskaņā ar kvantu mehānikas priekšstatiem piemīt ne tikai daļiņu, bet arī viļņu īpašības. To kustību atomā apraksta, izmantojot viļņu funkciju, kam dažādās atoma vietās ir dažāda vērtība. Viļņu funkcijas kvadrāts raksturo elektrona atrašanās varbūtību noteiktā telpas punktā, un pastāv priekšstats par "elektrona mākoni", kura blīvums dažādos punktos ir proporcionāls elektrona atrašanās varbūtībai šajos punktos. Dažreiz terminu 'elektrona mākonis' lieto kā sinonīmu terminam 'orbitāle'.[2] Tomēr orbitāļu forma (izņemot vienkāršākās — s tipa orbitāles) nedaudz atšķiras no elektronu mākoņu formas, jo orbitāli apraksta viļņu funkcija, bet elektrona mākoni — tās kvadrāts.[3]
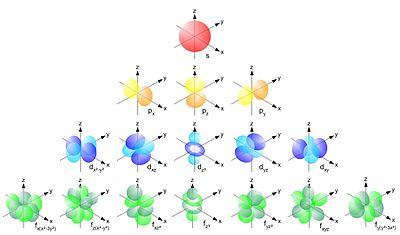
Orbitāļu apraksts ar kvantu skaitļiem
labot šo sadaļuLai viennozīmīgi aprakstītu atomārās orbitāles, izmanto tā saucamos kvantu skaitļus. Orbitāles enerģijas līmeni pamatā nosaka galvenais kvantu skaitlis, bet tās formu (enerģijas apakšlīmeni) — orbitālais kvantu skaitlis. Pirmajā enerģijas līmenī var būt tikai viena veida orbitāles — s orbitāles, kam ir sfēriska forma. Otrajā līmenī ir divu veidu jeb apakšlīmeņu orbitāles — lodveida s orbitāles un hanteles veida p orbitāles. Trešajā enerģijas līmenī bez s un p orbitālēm iespējamas vēl arī "četrlapiņu" d orbitāles, bet ceturtajā — papildus trim iepriekšējām vēl arī f orbitāles, kam ir vēl sarežģītāka forma. Piektajā līmenī teorētiski iespējamas vēl arī pavisam sarežģīta veida g orbitāles, tomēr līdz šim iegūto ķīmisko elementu atomos šīs orbitāles netiek aizpildītas, tajās elektroni atrodas tikai ierosinātos atomos.
Orbitāļu novietojumu telpā apraksta trešais kvantu skaitlis — magnētiskais kvantu skaitlis. Tā kā sfēriskās s veida orbitāles ir pilnīgi simetriskas, tām ir tikai viens magnētiskais kvantu skaitlis. Nākamā veida — p orbitālēm — ir iespējami trīs magnētiskie kvantu skaitļi, kas atbilst "hanteles" novietojumam pa X, Y vai Z asi Dekarta koordinātu sistēmā. d orbitālēm atbilst jau 5 magnētiskie kvantu skaitļi, tādēļ iespējami pieci d orbitāļu novietojumi — četros veidos telpā novietota četrlapiņu figūra un vēl viens sarežģītāks veids — hantele ar gredzenu. Katram nākamajam orbitāles tipam magnētiskais kvantu skaitlis pieaug par 2. Iespējami 7 f orbitāļu novietojumi vai 9 g orbitāļu novietojumi. Līdz ar to pirmajā enerģijas līmenī kopā iespējama tikai viena orbitāle, otrajā — četras (viena s un trīs p orbitāles), trešajā — 9 (1 s, 3 p, 5 d orbitāles), t.i., iespējamo orbitāļu skaits dotajā enerģijas līmenī vienāds ar līmeņa numura kvadrātu.
Pastāv vēl arī ceturtais kvantu skaitlis — spina kvantu skaitlis. Katrai orbitālei atbilst divi spina kvantu skaitļi. Spinu vienkāršoti var iztēloties kā elektrona griešanos ap savu asi, bet rotācija iespējama divos virzienos. Tādēļ vienā orbitālē saskaņā ar Pauli principu var atrasties divi elektroni. Pauli princips nosaka, ka atomā nevar būt divi elektroni, kam vienādi visi četri kvantu skaitļi. Tādējādi katrā atoma enerģijas līmenī iespējamais maksimālais elektronu skaits vienāds ar divkāršotu enerģijas līmeņa numura jeb galvenā kvantu skaitļa kvadrātu. Atoma orbitāļu kopumu ar vienādu galveno kvantu skaitli sauc par elektronu čaulu. Elektronus, kas atrodas ārējā elektronu čaulā, sauc par vērtības elektroniem jeb valences elektroniem.
Atomu orbitāļu aizpildīšanās
labot šo sadaļuNeierosinātu atomu orbitāles aizpildās ar elektroniem tā, lai elektroni atrastos viszemākajos iespējamos enerģētiskajos stāvokļos. Orbitāļu enerģija pieaug šādā secībā (cipars nozīmē galveno kvantu skaitli jeb elektronu čaulas numuru):
- 1s < 2s < 2p < 3s < 3p < 4s≈3d < 4p < 5s≈4d < 5p < 6s≈5d≈4f < 6p utt.
Elektronu čaulas aizpildīšanos (galvenais kvantu skaitlis vienāds) nosaka Kļečkovska likums, bet enerģijas apakšlīmeņu (galvenais un orbitālais kvantu skaitlis vienādi) aizpildīšanos raksturo Hunda likums.
Elektronu sadalījuma atomā pa čaulām īsu pierakstu sauc par elektronu konfigurāciju vai elektronformulu. Piemēram, slāpekļa atoma elektronu konfigurācija ir 1s22s22p3. Tas nozīmē, ka pirmajā elektronu čaulā s orbitālē ir divi elektroni (šī čaula ir pilnīgi aizpildīta un atbilst hēlija atoma konfigurācijai), bet otrajā čaulā atrodas 2 elektroni s orbitālē un 3 elektroni p orbitālē. Kopā slāpekļa atomam ir 7 elektroni, kas atbilst tā atomskaitlim jeb vietas numuram ķīmisko elementu periodiskajā tabulā. Pieci no šiem elektroniem atrodas ārējā čaulā, tādējādi slāpekļa maksimālā vērtība var būt 5.
Ja atoms absorbē vai izstaro enerģijas kvantu, mainās tā elektronu kvantu skaitļi un elektronu mākoņu forma.
Skatīt arī
labot šo sadaļuAtsauces
labot šo sadaļu| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: atomārās orbitāles |
| Šis ar fiziku saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |