Slāpekļa oksīdi
(Pāradresēts no Slāpekļa oksīds)
Slāpekļa oksīdi ir slāpekļa un skābekļa binārie savienojumi. Ir pazīstami pieci "klasiskie" slāpekļa oksīdi (divi no tiem bez tam var eksistēt dimēru formā) un 3 ļoti nestabili "eksotiskie" slāpekļa oksīdi. Ekoloģijā ar terminu 'slāpekļa oksīdi' parasti saprot slāpekļa(II) oksīda NO un slāpekļa(IV) oksīda NO2 summu, ko mēdz apzīmēt ar NOx[1], atsevišķi izdalot dislāpekļa oksīdu N2O. Bioloģijā, runājot par slāpekļa oksīdu, ar to bieži saprot slāpekļa(II) oksīdu NO.
- Dislāpekļa oksīds N2O. Bezkrāsaina gāze. Atšķiras no pārējiem slāpekļa oksīdiem ar stabilitāti un nekaitīgumu.
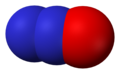
- Slāpekļa(II) oksīds NO. Liela nozīme bioloģijā. Bezkrāsas gāze, kas gaisā ātri oksidējas līdz NO2. Veido nestabilu dimēru N2O2.
- Slāpekļa(III) oksīds N2O3. Pastāv zemās temperatūrās kā zili kristāli vai tumši zils šķidrums. Reaģē ar ūdeni, rodoties slāpekļpaskābei.
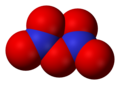
- Slāpekļa(IV) oksīds NO2. Brūna, ļoti indīga gāze. Viegli dimerizējas par bezkrāsainu vielu N2O4.
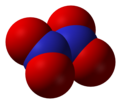
- Slāpekļa(V) oksīds N2O5. Bezkrāsaini, nestabili kristāli. Reaģē ar ūdeni, rodoties slāpekļskābei.
- Nitrozilazīds N4O jeb NON3. Dzeltenīgs šķidrums, kas pastāv tikai temperatūrās, zemākās par −50 °C. Sadalās par slāpekli un dislāpekļa oksīdu.
- Nitrilazīds N4O2 jeb NO2N3. Pastāv tikai zemās temperatūrās, šķidrā CO2 izšķīdinātā veidā. Viegli sadalās par dislāpekļa oksīdu.
- Trinitramīds N(NO2)3 jeb N4O6. Pirmo reizi iegūts 2010. gadā, pastāv tikai šķīdumos, cietās fāzes stabilitāte nav vēl zināma.
- Oksatetrazols N4O. Hipotētiska heterocikliskajiem savienojumiem līdzīga viela ar aromātiskām īpašībām. Oksatetrazola pieclocekļu gredzenā ir četri slāpekļa un viens skābekļa atoms.
-
Slāpekļa(IV) oksīds, NO2 -
Dislāpekļa oksīds, N2O -
Slāpekļa(III) oksīds, N2O3 -
Slāpekļa(IV) oksīda dimērs, N2O4 -
Slāpekļa(V) oksīds, N2O5 -
Trinitramīds, N(NO2)3
Atsauces
labot šo sadaļu- ↑ Vides zinātne, Māra Kļaviņa redakcijā. Rīga : LU Akadēmiskais apgāds, 2008, 153. lpp.
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |