Nātrija sulfāts
Nātrija sulfāts (Na2SO4, glaubersāls Na2SO4·10 H2O) ir balta, kristāliska viela, kas šķīst ūdenī. Tas ir stabils, neitrāls sāls. Dabā nātrija sulfāts parasti ir sastopams dekahidrāta formā ar 10 kristalizācijas ūdens molekulām (mirabilīts).
| Nātrija sulfāts | |
|---|---|
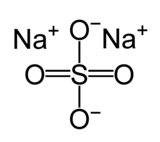 Nātrija sulfāta struktūrformula  Bezūdens nātrija sulfāts | |
| Citi nosaukumi | glaubersāls |
| CAS numurs |
7757-82-6 (bezūdens sāls), 7727-73-3 (dekahidrāts) |
| Ķīmiskā formula | Na2SO4 |
| Molmasa | 142,04 g/mol |
| Blīvums |
Bezūdens sālim 2680 kg/m3, dekahidrātam 1464 kg/m3 |
| Kušanas temperatūra |
1157 K (884 °C) (bezūdens), 32,4 °C (dekahidrāts) |
| Viršanas temperatūra | 1429 °C (bezūdens) |
| Šķīdība ūdenī |
4,76 g/100ml (0 °C); 42,7 g/100ml (100 °C) |
Iegūšana
labot šo sadaļuLielāko daļu nātrija sulfāta iegūst kā derīgo izrakteni. Dažreiz (ievērojami retāk), nātrija sulfāts ir sastopams anhidrīda formā (tenardīts), bet tas nav stabils un pamazām pārvēršas par mirabilītu. Apmēram 1/3 no pasaulē saražotā nātrija sulfāta iegūst kā dažādu ķīmisko procesu blakusproduktu. Nozīmīgākie šādi procesi ir sālsskābes ražošana no sērskābes un nātrija hlorīda, kā arī dažu polimēru ražošana (ķīmiskajām šķiedrām).
- 2NaCl + H2SO4 → 2HCl + Na2SO4
Īpašības
labot šo sadaļuNātrija sulfāts normālos apstākļos ir ļoti stabila viela. Paaugstinātā temperatūrā to ir iespējams reducēt par nātrija sulfītu (un vēl augstākā temperatūrā - par nātrija oksīdu). Nātrija sulfāts ir neitrāls sāls, kura šķīdumiem pH ir 7. Tas ir tāpēc, ka tas ir veidojies no stipras skābes (sērskābe) un sārma (nātrija hidroksīds). Nātrija sulfāts reaģē ar tādu pašu daudzumu sērskābes, veidojot nātrija hidrogēnsulfātu (skābo sāli):
- Na2SO4 + H2SO4 ⇌ 2NaHSO4
Tā ir līdzsvara reakcija un tās stāvoklis ir atkarīgs no temperatūras, koncentrācijas un citu vielu klātbūtnes. Nātrija sulfātam ir neparasta šķīdības atkarība no temperatūras. Zemās temperatūrās šķīdība ir maza, temperatūru intervālā no ~0 °C līdz 32,4 °C šķīdība pieaug ~10 reizes, tālāka temperatūras paaugstināšana šķīdību ietekmē maz (šķīdība nedaudz samazinās).
Izmantošana
labot šo sadaļuNātrija sulfāts parasti ir visai lēts materiāls. To lieto par pildvielu veļas pulveriem, celulozes ražošanai (lai izšķīdinātu lignīnu) un stikla ražošanai, lai ievadītu nātriju (šeit to lieto tikai tāpēc, ka tas ir lēts — lietojot nātrija sulfātu, krāsns dūmgāzes satur sēra dioksīdu).
Ārējās saites
labot šo sadaļu| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Nātrija sulfāts |