Amonija jons
Amonija jons jeb vienkārši amonijs ir pozitīvi lādēts vairākatomu jons ar formulu NH4+. Ja amonija joniem pievienojas anjoni (negatīvi lādēti joni), veidojas amonija sāļi, kas pieder pie tā dēvētajiem "onija" sāļiem.
| Amonija jons | |
|---|---|
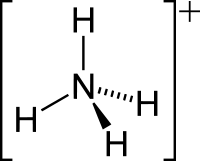 Amonija jona struktūrformula   Amonija jona modeļi | |
| Citi nosaukumi | amonijs |
| CAS numurs | 14798-03-9 |
| Ķīmiskā formula | NH4+ |
| Molmasa | 18,04 g/mol |
Amonija jonam ir tetraedriska forma, kur centrā ir slāpekļa atoms, kam apkārt izvietojušies ūdeņraža atomi. Jona izmērs ir 1,43 Å.[1]

Amonija joni viegli veidojas, amonjakam reaģējot ar skābēm:
- NH3 + HCl → NH4Cl
Ūdens šķīdumos amonija sāļi disociē:
- NH4Cl ⇄ NH4+ + Cl−
Ūdeņraža atomi amonija jonā var tikt aizvietoti ar citiem atomiem, piemēram, fluora atomiem (tetrafluoramonija katjons [NF4]+). Tie var aizvietoties arī ar organiskām grupām. Ja visi ūdeņraža atomi amonija jonā tiek aizvietoti ar metilgrupām, rodas tetrametilamonija jons. Atšķirībā no amonija hidroksīda, kas pastāv (nosacīti) tikai ūdens šķīdumos, tetrametilamonija hidroksīds ir samērā stabila viela.
Atsauces
labot šo sadaļu| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: amonija jons |
- ↑ Nails Ahmetovs. Neorganiskā ķīmija. Rīga : Zvaigzne, 1978, 371. lpp.
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |